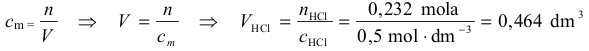Odpowiedź:
Przykłady poprawnych odpowiedzi
Dane:
67% Ni
32% Cu
1% Mn
cHCl = 0,5 mol · dm−3
mstopu = 10 g
32% Cu
1% Mn
cHCl = 0,5 mol · dm−3
mstopu = 10 g
Szukane:
VHCl
VHCl
Rozwiązanie:
I sposób
Masa Ni w 10 g stopu zawierającego 67% Ni wynosi 6,7 g.
Masa Mn w 10 g stopu zawierającego 1% Mn wynosi 0,1 g.
Masa Mn w 10 g stopu zawierającego 1% Mn wynosi 0,1 g.
Obliczenie liczby moli HCl potrzebnego do roztworzenia Ni:
59 g Ni – 2 mole HCl
6,7 g Ni – x
59 g Ni – 2 mole HCl
6,7 g Ni – x
x = 0,227 mola
Obliczenie liczby moli HCl potrzebnego do roztworzenia Mn:
55 g Mn – 2 mole HCl
0,1 g Mn – y
55 g Mn – 2 mole HCl
0,1 g Mn – y
y = 0,004 mola
Obliczenie łącznej liczby moli HCl:
nHCl = 0,227 mola + 0,004 mola = 0,231 mola
nHCl = 0,227 mola + 0,004 mola = 0,231 mola
Obliczenie objętości kwasu solnego:
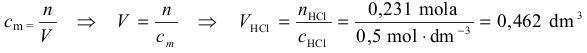
II sposób
Masa Ni w 10 g stopu zawierającego 67% Ni wynosi 6,7 g.
Masa Mn w 10 g stopu zawierającego 1% Mn wynosi 0,1 g.
Masa Mn w 10 g stopu zawierającego 1% Mn wynosi 0,1 g.
Obliczenie liczby moli Ni:
1 mol Ni – 59 g
x moli Ni – 6,7 g
1 mol Ni – 59 g
x moli Ni – 6,7 g
x = 0,114 mola
Obliczenie liczby moli Mn:
1 mol Mn – 55 g
y moli Mn – 0,1 g
1 mol Mn – 55 g
y moli Mn – 0,1 g
y = 0,002 mola
Obliczenie liczby moli HCl:
1 mol Ni – 2 mole HCl
0,114 mola – x
0,114 mola – x
x = 0,228 mola
1 mol Mn – 2 mole HCl
0,002 mola – y
0,002 mola – y
y = 0,004 mola
Obliczenie łącznej liczby moli HCl:
nHCl = 0,228 mola + 0,004 mola = 0,232 mola
nHCl = 0,228 mola + 0,004 mola = 0,232 mola
Obliczenie objętości kwasu solnego: