Wskazówka:
Podstawą rozwiązania tego zadania jest możliwa do obliczenia różnica początkowej masy
blaszki i masy blaszki po wyjęciu jej z roztworu. Wiemy, że przyczyną zmiany masy blaszki
w czasie doświadczenia była reakcja chemiczna, której równanie zostało podane w opisie
doświadczenia. Wynika z niego, że metalem, który wydzielił się na blaszce, była miedź,
a metalem, który uległ roztworzeniu, czyli w formie jonów „przeszedł” do roztworu, był
materiał blaszki, tzn. glin. Opis doświadczenia wskazuje także, że otrzymana w wyniku
reakcji miedź nie wydzieliła się w postaci osadu, który gromadziłby się poza powierzchnią
blaszki, ponieważ roztwór pozostał klarowny . Dzięki temu możemy stwierdzić, że różnica
końcowej i początkowej masy blaszki Δm = mkońcowa − mpoczątkowa jest różnicą między masą
wydzielonej miedzi i masą roztworzonego glinu: Δm = mCu − mAl , a ponieważ masa
substancji jest iloczynem liczby moli i masy molowej tej substancji, różnicę masy blaszki
można wyrazić równaniem:
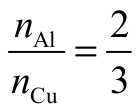
Δm = nCuMCu − nAlMAl
Z równania reakcji wynika zaś, że stosunek liczby moli miedzi i glinu jest równy
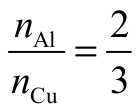
W ten sposób otrzymujemy układ dwóch równań z dwiema niewiadomymi, którymi są liczba
moli miedzi i liczba moli glinu. Rozwiązując ten układ równań, otrzymujemy liczbę moli
miedzi, dzięki czemu możemy obliczyć masę wydzielonej miedzi. Warto także zauważyć,
że w przykładowym rozwiązaniu użyto wartości masy molowej miedzi i glinu z dokładnością
do drugiego miejsca po przecinku (tak jak są one podane w zestawie Wybranych wzorów
i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki), ale można także
użyć wartości zaokrąglonych do jedności, jak to się zwykle robi w przypadku obliczeń
niewymagających bardzo dużej dokładności.