Wskazówka:
Aby poprawnie rozwiązać zadany problem, musisz najpierw przeczytać informację
wprowadzającą i przeanalizować konstrukcję zadania. W pierwszym zdaniu podana jest
informacja, że pH wody destylowanej jest równe 7. Musisz wiedzieć, że po dodaniu kwasu
pH roztworu będzie mniejsze od 7 (czyli zmaleje). W następnym kroku należy skorzystać
z danych i odpowiednio je powiązać, tzn.:
VH2O = 990 cm3
VHCl = 10 cm3 = 0,01 dm3 , cHCl = 1 mol ⋅ dm−3
VHCl = 10 cm3 = 0,01 dm3 , cHCl = 1 mol ⋅ dm−3
z tego wynika n = 0,01 mola
Otrzymana objętość końcowa (V') i stężenie końcowe (c') będą odpowiednio równe:
V' = 1 dm3 , n = 0,01 mola ⇒ c' = 0,01 mol ⋅ dm−3
Musisz także wiedzieć, że pH jest ujemnym logarytmem ze stężenia jonów H+:
pH = – log 0,01 = – log 10−2 ⇒ pH = 2
pH = – log 0,01 = – log 10−2 ⇒ pH = 2
Następnie porównaj stężenie jonów wodorowych w świeżo destylowanej wodzie ze stężeniem uzyskanym po wprowadzeniu kwasu, tzn.:
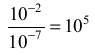
Przedstawione powyżej obliczenia są dosyć proste i w przypadku postawionego problemu możliwe do wykonania w pamięci.