Wskazówka:
Obliczenie odsetka (procentu) cząsteczek CO2 i H2 , które uległy przekształceniu w CO i H2O
wymaga obliczenia liczby cząsteczek CO i H2O, powstałych w wyniku reakcji. Dobrze jest
zauważyć, że mikroskopowa wielkość, jaką jest liczba cząsteczek substancji, jest wprost
proporcjonalna do makroskopowej wielkości określającej liczność materii, czyli liczby moli
substancji. Spostrzeżenie to pozwala na wykonywanie obliczeń z zastosowaniem liczby moli,
której nie trzeba przeliczać na liczbę cząsteczek. Punktem wyjścia do rozwiązania zadania jest
równanie reakcji i wyrażenie na jej stężeniową stałą równowagi, ponieważ dysponujemy
informacją o wartości tej stałej w temperaturze, w której reakcja była prowadzona.
Stężeniowa stała równowagi jest ilorazem 2 iloczynów stężeń molowych w stanie równowagi:
w liczniku są to stężenia produktów, a w mianowniku – stężenia substratów reakcji, wszystkie
w pierwszej potędze. Jeżeli uwzględnimy fakt, że reakcja przebiegała w fazie gazowej
w zamkniętym reaktorze o stałej pojemności, stwierdzimy, że w wyrażeniu na stałą
równowagi stężenia molowe substancji w stanie równowagi można zastąpić liczbą moli
poszczególnych substancji w stanie równowagi:
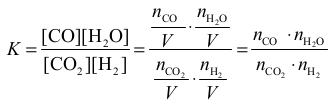
Analiza równania reakcji pozwala stwierdzić, że liczba moli powstałego CO jest równa
liczbie moli H2O i jest ona także liczbą moli tych substancji w stanie równowagi –
w mieszaninie początkowej substancji tych nie było. Liczba moli w stanie równowagi
substratów reakcji (CO2 i H2) to początkowa liczba moli tych substancji (równa 2 mole)
pomniejszona o liczbę moli, która uległa reakcji. Ten ubytek CO2 i H2 jest równy liczbie moli
otrzymanych CO i H2O. Widzimy więc, że nasz problem sprowadza się do obliczenia
niewiadomej (x), którą jest liczba moli produktów (a zarazem ubytek liczby moli substratów).
Dzięki wyrażeniu na stałą równowagi reakcji i znajomości jej wartości otrzymujemy
równanie z jedną niewiadomą:
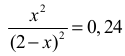
które sprowadzamy do postaci 0,76x2 + 0,96x − 0,96 = 0 .