Wskazówka:
Aby móc rozwiązać to zadanie, należy stwierdzić, czy reakcja jest egzo- czy endotermiczna,
a więc zinterpretować informację o jej entalpii:
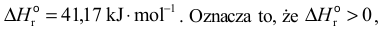
czyli w czasie reakcji energia wewnętrzna układu rośnie – układ pochłania energię na sposób
ciepła wtedy, gdy powstają CO i H2O. Im więcej energii układ pochłonie, tym więcej CO
i H2O powstanie. Wynika z tego, że w niższej temperaturze – bo 400 K < 800 K – czyli
wtedy, gdy układ jest słabiej ogrzewany, powstanie mniej CO i H2O, a więc stała równowagi
reakcji będzie mniejsza od 0,24.
Do takiego samego wniosku można dojść, stosując regułę przekory. Zgodnie z nią, układ
reaguje na zmianę tak, aby zmianę tę zniwelować. Jeżeli zmiana ta polega na ochłodzeniu,
układ będzie się ogrzewał przez zajście w większym stopniu reakcji przebiegającej
z wydzieleniem ciepła, czyli tworzenia CO2 i H2 , a więc wydajność tworzenia CO i H2O
będzie mniejsza, czyli stała równowagi reakcji będzie mniejsza od 0,24.
Odpowiedź w zadaniu można sformułować także, kierując się intuicją, która podpowiada,
że reakcja wymagająca dostarczenia ciepła będzie zachodzić w większym stopniu w wyższej
temperaturze.