Wskazówka:
Rozwiązanie zadania wymaga obliczenia liczby moli wszystkich jonów. Najpierw obliczamy
liczbę moli każdej soli – korzystamy ze wzoru na stężenie molowe, mając stężenie molowe
każdego roztworu i jego objętość, na przykład liczba moli CaCl2 w roztworze wynosi
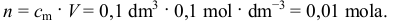
Następnie, uwzględniając dysocjację danego związku, obliczamy liczbę moli poszczególnych jonów. W przypadku CaCl2 :
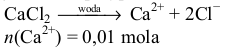
n(Cl−) = 2 · 0,01 = 0,02 mola
Tak należy postąpić również z roztworem NaCl i AgNO3 . Ponieważ roztwory te zmieszano,
konieczne jest ustalenie, czy jony będą ze sobą reagować, czy powstanie sól nierozpuszczalna
w wodzie. W omawianym zadaniu reaguje anion chlorkowy z kationem srebra i powstaje
nierozpuszczalny chlorek srebra(I): Ag+ + Cl− → AgCl. Mając obliczoną liczbę moli jonów
Cl− w poszczególnych roztworach substancji CaCl2 i NaCl, obliczamy sumaryczną liczbę moli
tych jonów.
Z zapisu reakcji wynika, że na 1 mol Ag+ przypada 1 mol Cl− . W roztworze znajduje się
0,01 mola Ag+ , więc może przereagować również 0,01 mola Cl− . Ponieważ w roztworze
znajdowało się 0,03 mola Cl− , oznacza to, że jony Ag+ zostały wytrącone w postaci AgCl,
w roztworze pozostały jony chlorkowe: 0,03 mola – 0,01 mola = 0,02 mola. W ten sposób
dochodzimy do wniosku, że w roztworze końcowym obecne były jony Ca2+ , Na+ , Cl− i NO3– .
Objętość roztworu po zmieszaniu była równa sumie objętości roztworów, które zmieszano:
V = 0,1 dm3 + 0,1 dm3 + 0,1 dm3 = 0,3 dm3 .
Mając liczby moli jonów obecnych w roztworze i objętość roztworu, możemy obliczyć ich stężenie, np.:
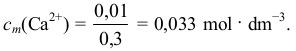
W identyczny sposób należy postąpić, obliczając stężenia pozostałych jonów.