Wskazówka:
Warunkiem poprawnego rozwiązania zadania jest znajomość reakcji hydrolizy soli.
We wszystkich probówkach sole są dobrze zdysocjowane i występują w roztworze wodnym
w postaci jonów. Należy zwrócić uwagę, czy rozpuszczona sól powstała z mocnej/słabej
zasady, czy z mocnego/słabego kwasu. Jony węglanowe (w probówce I) i jony
siarczanowe(IV) (w probówce IV) stanowią według teorii Brønsteda zasady wchodzące
w reakcję z cząsteczkami wody pełniącymi funkcję kwasu:
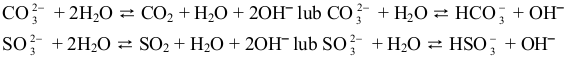
Utworzone w nadmiarze jony OH– zaburzają równowagę dysocjacji wody, jaka ustaliła się
w czystym rozpuszczalniku. Po ustaleniu się nowej równowagi stężenie jonów OH– jest
większe niż stężenie jonów H3O+ , stąd odczyn wodnych roztworów soli w probówce I i IV
jest zasadowy. Po rozpuszczeniu w wodzie chlorku żelaza(III) (probówka III) jony Fe3+
reagują z cząsteczkami wody jak kwas:
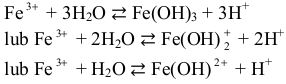
Powstające jony H+ (H3O+) są przyczyną kwasowego odczynu wodnego roztworu chlorku
żelaza(III).
Jony pochodzące od mocnych kwasów i mocnych zasad – obecne w wodnym roztworze
wskutek dysocjacji chlorku wapnia (probówka II) – nie reagują z wodą, zatem roztwór ten ma
odczyn obojętny.