Wskazówka:
Aby wykazać, że po zmieszaniu roztworów w zlewce wytrącił się osad, należy obliczyć
lokalny iloczyn IL = [Ca2+] ⋅ [F−]2 i porównać go z iloczynem rozpuszczalności fluorku
wapnia. Jeżeli lokalny iloczyn stężeń jonów wapnia i jonów fluorkowych do drugiej potęgi okaże się większy od iloczynu rozpuszczalności fluorku wapnia, będzie to oznaczać, że osad
się wytrącił. Najpierw należy obliczyć liczbę moli chlorku wapnia, wiedząc, że:
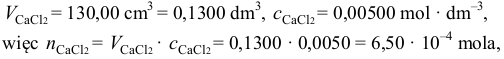
następnie należy obliczyć liczbę moli fluorku sodu, wiedząc, że:
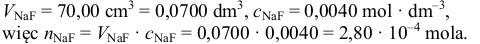
Następnie musimy zauważyć, że – zgodnie z równaniami dysocjacji jonowej:
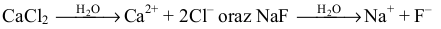
– liczba moli kationów wapnia jest równa liczbie moli chlorku wapnia (molowy stosunek
stechiometryczny 1 : 1) i liczba moli anionów fluorkowych jest równa liczbie moli fluorku
sodu (molowy stosunek stechiometryczny = 1 : 1), dlatego
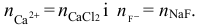
Powinniśmy także zauważyć, że objętość nowopowstałego roztworu będzie równa sumie
objętości roztworów zmieszanych ze sobą: V t = V CaCl 2 + V NaF = 0,200 dm 3 . Mając liczbę moli
kationów wapnia i anionów fluorkowych oraz objętość nowopowstałego roztworu, możemy
obliczyć stężenia reagujących ze sobą jonów w tym roztworze zaraz po zmieszaniu roztworów początkowych:
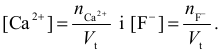
Następnie zapisujemy równanie reakcji wytracania osadu fluorku wapnia: Ca2+ + 2F– → CaF2↓
oraz wyrażenie na lokalny iloczyn IL=[Ca2+]⋅[ F−]2 , pamiętając, że stężenie jonów
fluorkowych występuje w potędze drugiej ze względu na prawo działania mas (wykładnik
w potędze stężenia jest równy współczynnikowi stechiometrycznemu reagenta). Po obliczeniu
wartości iloczynu lokalnego:
IL=[Ca2+]⋅[ F−]2 = 3,25 ⋅ 10−3 ⋅ (1 ,40 ⋅ 10−3) 2 = 6,37 ⋅ 10−9
stwierdzamy, że jego wartość jest większa niż wartość iloczynu rozpuszczalności Kso(CaF2)=3,16⋅10−11 . Jest to dowód na wytrącenie się osadu w zlewce.