Wskazówka:
Aby rozwiązać tę część zadania, trzeba pamiętać, że utleniacz to cząstka chemiczna (atom,
cząsteczka, jon), która w czasie reakcji pobiera elektrony, ulegając redukcji i utleniając
reduktor. Reduktor to cząstka chemiczna (atom, cząsteczka, jon), która w czasie reakcji
oddaje elektrony, ulegając utlenieniu i redukując utleniacz. Przyjmowanie elektronów
prowadzi do zmniejszenia stopnia utlenienia, więc stopień utlenienia utleniacza w czasie
reakcji maleje, natomiast oddawanie elektronów prowadzi do zwiększenia stopnia utlenienia, zatem stopień utlenienia reduktora w czasie reakcji wzrasta. Widzimy, że w reakcji
zilustrowanej schematem I zmianom ulega stopień utlenienia tylko manganu i siarki (wodór
przed i po reakcji występuje na I stopniu utlenienia, a tlen na –II stopniu utlenienia): w jonie 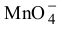 mangan przyjmuje stopień utlenienia równy VII, a w jonie Mn2+ – stopień utlenienia
równy II, natomiast siarka przechodzi z –II stopnia utlenienia w jonie S2− na stopień
utlenienia równy 0 w siarce elementarnej (S). Wynika z tego, że w opisanej reakcji
utleniaczem jest jon
mangan przyjmuje stopień utlenienia równy VII, a w jonie Mn2+ – stopień utlenienia
równy II, natomiast siarka przechodzi z –II stopnia utlenienia w jonie S2− na stopień
utlenienia równy 0 w siarce elementarnej (S). Wynika z tego, że w opisanej reakcji
utleniaczem jest jon 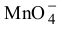 , a reduktorem – jon S2−.
, a reduktorem – jon S2−.
W reakcji, której schemat oznaczono numerem II, zmianom ulega stopień utlenienia tylko siarki i jodu (wodór przed i po reakcji występuje na I stopniu utlenienia, a tlen na –II stopniu utlenienia): w jonie 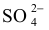 siarka
przyjmuje stopień utlenienia równy VI, a w cząsteczce H2S – stopień utlenienia równy –II,
natomiast jod przechodzi z –I stopnia utlenienia w jonie I − na stopień utlenienia równy 0 w cząsteczce jodu I2 . Wynika z tego, że w opisanej reakcji utleniaczem jest jon
siarka
przyjmuje stopień utlenienia równy VI, a w cząsteczce H2S – stopień utlenienia równy –II,
natomiast jod przechodzi z –I stopnia utlenienia w jonie I − na stopień utlenienia równy 0 w cząsteczce jodu I2 . Wynika z tego, że w opisanej reakcji utleniaczem jest jon 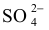 a reduktorem – jon I− .
a reduktorem – jon I− .