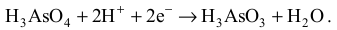Wskazówka:
Rozwiązanie zadania należy rozpocząć od wyznaczenia stopni utlenienia atomów
poszczególnych pierwiastków w drobinach chemicznych substratów i produktów reakcji,
co ułatwia, zawarta w nazwach kwasów arsenowych, informacja o stopniach utlenienia
arsenu: w cząsteczkach kwasu ortoarsenowego(III) atomy arsenu przyjmują stopień utlenienia
III, a w cząsteczkach kwasu ortoarsenowego(V) – stopień utlenienia V. Trzeba pamiętać także,
że w przypadku typowych związków (a z takimi mamy do czynienia w tej reakcji) wodór
występuje na I stopniu utlenienia, a tlen na –II stopniu utlenienia. Stopień utlenienia cyny jest
podany wprost, ponieważ drobiny chemiczne, w postaci których pierwiastek ten występuje
w opisanej reakcji, to kationy proste: Sn2+ i Sn4+ (to samo dotyczy wodoru w postaci
kationów wodorowych H+ ), a wiec przed reakcją cyna występuje na II stopniu utlenienia,
a w wyniku reakcji przechodzi na IV stopień utlenienia. W ten sposób mamy określone
wszystkie stopnie utlenienia:

Widzimy, że stopień utlenienia zmieniają atomy dwóch pierwiastków: arsenu i cyny. Stopień
utlenienia arsenu zmienia się z V w kwasie ortoarsenowym(V) na III w kwasie
ortoarsenowym(III), a cyny – z II w jonach Sn2+ na IV w jonach Sn4+ . Wynika z tego,
że w czasie reakcji stopień utlenienia arsenu zmniejsza się, arsen w kwasie ortoarsenowym(V)
jest więc utleniaczem, a stopień utlenienia cyny zwiększa się, co oznacza, że kationy cyny(II)
pełnią funkcję reduktora. Wiemy, że procesowi utlenienia ulega reduktor, który oddaje
elektrony, a procesowi redukcji – utleniacz, który przyłącza elektrony. Ponieważ stopień
utlenienia reduktora, czyli jonów Sn2+ , wzrasta o 2, równanie procesu utleniania będzie miało
następującą postać: Sn2+ → Sn4+ + 2e− .
Stopień utlenienia utleniacza, czyli atomów arsenu w cząsteczkach H3AsO4 , maleje także o 2,
możemy więc napisać, że H3AsO4 + 2e− → H3AsO3 , ale zapis ten nie jest jeszcze równaniem
reakcji, ponieważ liczba atomów tlenu (na –II stopniu utlenienia) po lewej stronie nie jest
równa liczbie atomów tego pierwiastka po prawej stronie. Widzimy, że w środowisku reakcji
obecne są jony H+ , które w połączeniu z atomami tlenu na –II stopniu utlenienia tworzą cząsteczki wody będącej produktem ubocznym reakcji. Aby liczba atomów tlenu była taka sama po obu stronach równania, trzeba przyjąć, że powstaje jedna cząsteczka wody, do czego potrzebne są 2 jony H+ :

Łącząc ten zapis z zapisem ilustrującym zmiany stopnia utlenienia arsenu, otrzymujemy następujące równanie procesu redukcji: