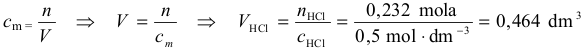Wskazówka:
Korzystając z podanej informacji, należy obliczyć masę niklu i manganu zawartą w 10 g
stopu. Masa niklu w 10 g stopu zawierającego 67% tego metalu wynosi 6,7 g, a masa
manganu w 10 g stopu zawierającego 1% tego metalu wynosi 0,1 g. Następny krok,
to obliczenie liczby moli tych metali w obliczonych ich masach (wartości masy molowej
niklu i manganu z układu okresowego):
1 mol Ni – 59 g
x moli Ni – 6,7 g
x moli Ni – 6,7 g
x = 0,114 mola
1 mol Mn – 55 g
y moli Mn – 0,1 g
y moli Mn – 0,1 g
y = 0,002 mola
Mając liczby moli obu metali, można obliczyć – korzystając z równań reakcji – liczbę moli kwasu solnego:
1 mol Ni – 2 mole HCl
0,114 mola – x
0,114 mola – x
x = 0,228 mola
1 mol Mn – 2 mole HCl
0,002 mola – y
0,002 mola – y
y = 0,004 mola
Łączna liczba moli kwasu potrzebna do całkowitego roztworzenia obu metali wynosi
nHCl = 0,228 mola + 0,004 mola = 0,232 mola.
Mając liczbę moli kwasu i stężenie molowe jego roztworu, należy obliczyć objętość roztworu kwasu.