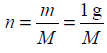Wskazówka:
W reakcjach rozcieńczonego kwasu siarkowego(VI) z magnezem, żelazem i cynkiem
powstają sole tych metali (siarczany(VI)) oraz wydziela się wodór. W przypadku wszystkich
użytych w doświadczeniu metali schemat tej reakcji jest jednakowy:
Me + H2SO4 → MeSO4 + H2
Oznacza to, że w reakcji każdego z tych 3 metali stosunek molowy metalu do kwasu
i wydzielonego wodoru wynosi 1 : 1 : 1. Masy użytych do reakcji metali są jednakowe (równe
1 g). Należy obliczyć, ile moli każdego z tych metali znajduje się w 1 g metalu i odnieść ich
wartości do objętości wydzielanego wodoru. Najwięcej wodoru wydzieli się w przypadku
metalu, którego liczba moli była największa, a największą liczbę moli otrzymamy dla metalu
o najmniejszej masie molowej, ponieważ obliczamy ją ze wzoru: