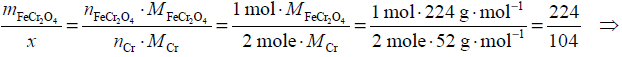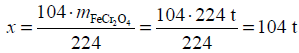Wskazówka:
Najpierw należy obliczyć zawartość chromitu w dostarczonej rudzie, wiedząc, że 20%
stanowią zanieczyszczenia, zatem 80% stanowi czysty chromit. Obliczamy:
80% · 280 t = 0,8 · 280 t = 224 t
Następnie na podstawie równania reakcji układamy masowy stosunek stechiometryczny
reagentów oraz obliczamy masę molową chromitu:
MFeCr2O4 = MFe + 2MCr + 4MO = 1 · 56 g · mol–1 + 2 · 52 g · mol–1 + 4 · 16 g · mol–1 = 224 g · mol–1
Masa molowa koksu, czyli węgla, wynosi MC = 12 g · mol–1. Ze stosunku stechiometrycznego ustalonego na podstawie współczynników stechiometrycznych reagentów biorących udział w reakcji, której równanie jest podane w informacji:
FeCr2O4 + 4C → 2Cr + Fe + 4CO
ustalamy, że stosunek liczby moli nFeCr2O4 : nC = 1 : 4, stosunek masowy reagentów biorących udział w reakcji wynosi:
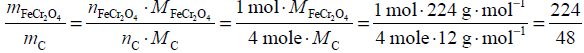
Widzimy, że masowy stosunek stechiometryczny reagentów z danych zadania jest taki sam:
mFeCr2O4 : mC = 224 t : 48 t = 224 : 48, co oznacza, że substraty zmieszano w stosunku
stechiometrycznym i przereagują one całkowicie zgodnie z masowym stosunkiem
stechiometrycznym, możemy zatem obliczyć masę chromu, który by otrzymano, gdyby
wydajność reakcji wynosiła 100%: