Wskazówka:
Aby rozwiązać zadanie, trzeba znać definicję stężenia procentowego i molowego roztworu.
Trzeba też umieć przeliczać stężenie procentowe na molowe. Podane jest stężenie procentowe
dwóch roztworów oraz ich gęstość. Ponieważ te same czynności wykonujemy dla obydwu
roztworów, wskazówki dotyczące obliczenia stężenia molowego podane zostaną tylko
dla jednego z nich. W pierwszej kolejności musisz ujednolicić jednostki. W tym celu przelicz
gęstość roztworu (1,0121 g · cm–3= 1012,1 g · dm–3) . Następnie, korzystając z układu
okresowego pierwiastków chemicznych (zestaw Wybrane wzory i stałe fizykochemiczne
na egzamin maturalny z biologii, chemii i fizyki), oblicz masę molową kwasu octowego
(M = 60 g · mol–1) . Kolejnym etapem może być wyprowadzenie wzoru, na podstawie którego
przeliczamy stężenie procentowe i molowe roztworu 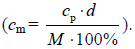 Dalej, podstawiając
do wzoru (wyprowadzonego lub zapamiętanego – nie musimy wzoru wyprowadzać) wartości
stężenia procentowego, gęstości roztworu, masy molowej kwasu octowego, oblicz stężenie
molowe (1,687 mol · dm–3 dla roztworu o stężeniu 10,00% i 1,007 mol · dm–3 dla roztworu
o stężeniu 6,00%; I sposób). Inna metoda rozwiązania tego zadania jest następująca
(II sposób): po przeliczeniu gęstości roztworu i wyznaczeniu masy molowej kwasu octowego,
oblicz objętość roztworu jako iloraz masy roztworu (można wyliczyć lub przepisać wartość
obliczoną w poprzednim zadaniu) i gęstości (Vr = 0,1976 dm3 dla roztworu o stężeniu 10,00%
i 0,331 dm3 dla roztworu o stężeniu 6%). Następnie, mając już wszystkie dane, oblicz stężenie molowe, podstawiając dane do odpowiedniego wzoru
Dalej, podstawiając
do wzoru (wyprowadzonego lub zapamiętanego – nie musimy wzoru wyprowadzać) wartości
stężenia procentowego, gęstości roztworu, masy molowej kwasu octowego, oblicz stężenie
molowe (1,687 mol · dm–3 dla roztworu o stężeniu 10,00% i 1,007 mol · dm–3 dla roztworu
o stężeniu 6,00%; I sposób). Inna metoda rozwiązania tego zadania jest następująca
(II sposób): po przeliczeniu gęstości roztworu i wyznaczeniu masy molowej kwasu octowego,
oblicz objętość roztworu jako iloraz masy roztworu (można wyliczyć lub przepisać wartość
obliczoną w poprzednim zadaniu) i gęstości (Vr = 0,1976 dm3 dla roztworu o stężeniu 10,00%
i 0,331 dm3 dla roztworu o stężeniu 6%). Następnie, mając już wszystkie dane, oblicz stężenie molowe, podstawiając dane do odpowiedniego wzoru 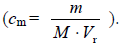 Należy przyjąć
poprawne zaokrąglenia wyników pośrednich i wyniku końcowego oraz pamiętać o podaniu
wyniku z odpowiednią jednostką. Pamiętaj, że wynik zależy od przyjętych zaokrągleń.
Należy przyjąć
poprawne zaokrąglenia wyników pośrednich i wyniku końcowego oraz pamiętać o podaniu
wyniku z odpowiednią jednostką. Pamiętaj, że wynik zależy od przyjętych zaokrągleń.