Odpowiedź:
Przykłady poprawnych odpowiedzi
Dane:
V mieszaniny = 2 m3
T = 300 °C
p = 10 MPa = 107 Pa
%NH3 = 52,1% (odczytane z tabeli)
R = 8,31 J · mol−1 · K−1 (odczytane z zestawu Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki)
p = 10 MPa = 107 Pa
%NH3 = 52,1% (odczytane z tabeli)
R = 8,31 J · mol−1 · K−1 (odczytane z zestawu Wybranych wzorów i stałych fizykochemicznych na egzamin maturalny z biologii, chemii i fizyki)
Szukane:
n NH3
n NH3
Rozwiązanie:
I sposób
Objętość amoniaku
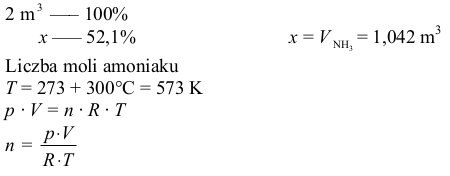
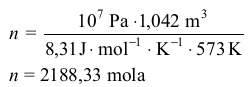
II sposób
Liczba moli reagentów
T = 273 + 300 °C = 573 K
p · V = n · R · T
T = 273 + 300 °C = 573 K
p · V = n · R · T
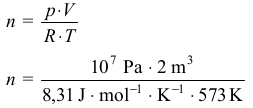
n = 4200,25 mola
Liczba moli amoniaku
4200,25 mola — 100%
x — 52,1%
Liczba moli amoniaku
4200,25 mola — 100%
x — 52,1%
x = n = 2188,33 mola
Odpowiedź: w 2 m3 mieszaniny reakcyjnej w temperaturze 300°C i pod ciśnieniem 10 MPa (107 Pa), po ustaleniu stanu równowagi znajduje się 2188,33 mola amoniaku.