Wskazówka:
Rozwiązanie zadania wymaga obliczenia początkowej szybkości reakcji zgodnie z podanym
równaniem kinetycznym tej reakcji:
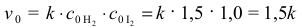
Jeżeli przereagowało 50% jodu, to przy stałej objętości reaktora stężenie jodu zmalało
o połowę, dlatego stężenie pozostałego w reaktorze jodu będzie wynosić cI2 = 0,5 mol · dm−3 ,
a ubytek stężenia jodu ΔcI2 = 0,5 mol · dm−3 .
Z równania reakcji wynika, że wodór i jod reagują w stosunku molowym
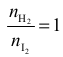
więc
ubytek stężenia wodoru jest równy ubytkowi stężenia jodu: ΔcH2 = ΔcI2 = 0,5 mol · dm−3 ,
zatem stężenie wodoru po przereagowaniu 50% jodu osiągnęło wartość:
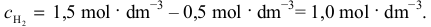
Znając stężenie obu substratów w momencie po przereagowaniu 50% jodu, możemy obliczyć szybkość reakcji w tym momencie:
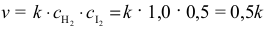
W ten sposób obliczymy stosunek szybkości reakcji w momencie po przereagowaniu 50% jodu i szybkości początkowej:
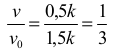
na podstawie którego możemy stwierdzić, że szybkość reakcji zmaleje 3 razy.