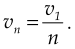Zadanie 5.
Model atomu wodoru Bohra był pierwszym, który wprowadził stany stacjonarne. Według modelu, elektron może znajdować się w atomie wodoru jedynie na orbitach dozwolonych, wówczas nie promieniuje energii. Energia atomu wodoru w przypadku, gdy elektron znajduje się na pierwszej orbicie dozwolonej, wynosi
E1 = − 13,6 eV, natomiast energię, wyrażoną w elektronowoltach (eV), na dowolnej (
n) orbicie można wyliczyć z zależności:
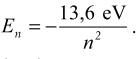
Podczas przeskoku elektronu z orbity początkowej o energii
Ep na orbitę docelową o energii
Ek (
Ep > E
k) zostaje wyemitowany foton o energii:
Ep − Ek =
h·f .
Wartość prędkości liniowej, z jaką porusza się elektron na orbicie stacjonarnej, zależy od promienia tej orbity. Przyjmując, że
v1 to wartość prędkości na orbicie pierwszej, wartość prędkości na dowolnej orbicie
n można wyrazić jako