Zadanie 3.
Na rysunkach przedstawiono przestrzenne rozmieszczenie wiązań chemicznych tworzonych przez orbitale zhybrydyzowane atomów węgla w cząsteczkach dwóch węglowodorów. Punktami schematycznie oznaczono położenie środków atomów połączonych tymi wiązaniami, linią ciągłą – osie wiązań, a linią przerywaną – kontury figury geometrycznej, w której narożach znajdują się atomy otaczające atom centralny. Hybrydyzacja polegająca na wymieszaniu 1 orbitalu s oraz 3 orbitali p daje hybrydyzację tetraedryczną ze względu na skierowanie orbitali zhybrydyzowanych ku narożom tetraedru. Wymieszanie 1orbitalu s oraz 2 orbitali p daje hybrydyzację trygonalną. Wiązania utworzone za pomocą tych orbitali leżą w tej samej płaszczyźnie, a kąty pomiędzy nimi wynoszą 120°.
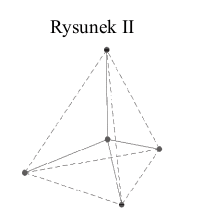
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2011, s. 151, 152, 155,156.